
Noticias para Profesionales
Alergia a fármacos: Utilidad diagnóstica del test de transformación linfoblástica
Las reacciones de hipersensibilidad a fármacos (DHRs) son reacciones adversas a fármacos que parecen clínicamente alérgicas. Las alergias a fármacos son DHRs en las que se ha demostrado un mecanismo inmunológico adaptativo. Las DHRs no inmediatas suceden en cualquier momento después de la primera hora de administración del fármaco. Entre los síntomas habituales en estas entidades se destacan los exantemas máculopapulares y la urticaria retardada. A menudo, se deben a un mecanismo alérgico dependiente de los Linfocitos T.
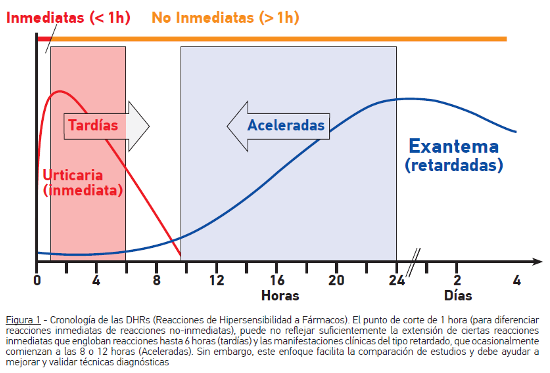
La piel resulta el blanco más frecuente en las DHRs No inmediatas, a menudo se observan síntomas cutáneos variables, como urticaria retardada, erupciones máculopapulares, erupciones fijas medicamentosas, vasculitis, enfermedades ampollosas, como Necrosis Epidermica Tóxica (TEN), Síndrome de Stevens-Johnson (SJS) y erupciones bullosas fijas generalizadas), pustulosis exantemática aguda generalizada (AGEP) y exantemas intertriginosos simétricos y flexurales secundarios a fármacos (SDRIFE). Los órganos internos pueden estar afectados de forma exclusiva o con síntomas cutáneos asociados (HSS/DRESS/DiHS, vasculitis, SJS/TEN) y puede observarse hepatitis, fallo renal, neumonitis, anemia, neutropenia y/o trombocitopenia.
La mayoría de los medicamentos son compuestos de bajo peso molecular y composición química simple, y sus estructuras no son fácilmente reconocibles por el sistema inmune, que solo de forma excepcional es capaz de reconocer sustancias de peso molecular inferior a 5000 δ. Son moléculas demasiado pequeñas para interactuar con los receptores inmunes con suficiente potencia para activar los LT o LB. En su estado original, la mayoría de los fármacos no tienen capacidad inmunogénica. Sin embargo, si el fármaco es presentado a los linfocitos por una célula presentadora de antígeno (una célula dendrítica, por ejemplo) tanto en su forma original como si se modifica tras su metabolización, puede desarrollar una respuesta inmune específica mediada por LT, o mediada predominantemente por anticuerpos, o tener características de ambos tipos de respuesta.
Existen dos hipótesis principales que explican la capacidad de los fármacos para generar respuestas inmunológicas. La hipótesis hapteno-proteína sugiere que para desencadenar una reacción (esto es, convertirse en un inmunógeno) una droga de bajo peso molecular debe unirse irreversiblemente a una proteína. Esta unión generaría un neo-antígeno que tras su correspondiente procesamiento y presentación desencadenaría respuestas inmunológicas eficientes. La hipótesis alternativa sería el llamado concepto p-i. Esta teoría propugna la existencia de interacciones directas (Sin procesamiento intracelular previo) de la droga con el receptor immune (receptores del LT o moléculas de HLA). Esta interacción podría modificar por ejemplo la hendidura de unión a péptido de la molécula de HLA y producir así la activación de LT específicas (por ejemplo la unión de Abacavir con HLA-B*5701).
Las interacciones medicamentosas con el receptor del LT (TCR) normalmente implican un asociación medicamento/péptido exhibido en el complejo mayor de histocompatibilidad (CMH) de células presentadoras de antígenos (CPA) o células accesorias. Esto ocurre, por ejemplo, para medicamentos químicamente reactivos como ß-lactámicos (mecanismo del hapteno), que forman enlaces covalentes con residuos de aminoácidos de proteínas. Otros medicamentos, como el sulfametoxazol, deben ser metabolizados o bioactivados a formas químicamente reactivas antes de que sean capaces de unirse covalentemente a proteínas.
Fármacos químicamente inertes, como lidocaína y carbamazepina, son incapaces de unirse covalentemente a péptidos o proteínas; sin embargo, pueden asociarse con una baja afinidad al TCR y provocar la activación de los LT. La mayoría de las reacciones mediadas por los LT son debidas al mecanismo concepto p-i (sulfonamidas, anestésicos locales, lamotrigina, carmazepina, etc).

Han sido reportados Test de transformación linfoblástica (TTL) positivo para diferentes grupos de drogas: antibióticos (b-lactámicos, quinolonas, sulfonamides, etc.), antiepilépticos (lamotrigina, carbamazepina, fenobarbital, fenitoína), antihipertensivos, anestésicos locales, diuréticos, vitaminas, etc.
Un diagnóstico concluyente de DHR es necesario, con el fin de establecer las medidas preventivas adecuadas; sin embargo es dificultoso, ya que una enorme cantidad de drogas diferentes pueden producir variadas enfermedades inmuno-mediadas con distintos mecanismos patológicos.
Las herramientas clínicas que permiten un diagnóstico concluyente son una historia clínica completa, pruebas cutáneas estandarizadas, pruebas in vitro fiables y pruebas de provocación a medicamentos. No hay una prueba diagnóstica o de cribado in vitro que permita establecer que un individuo pueda padecer o no una reacción alérgica frente a determinado fármaco. Sin embargo, cuando un paciente ya ha presentado alguna reacción alérgica frente a un fármaco, anestésico o medio de contraste, existe la posibilidad de predecir posibles reacciones alérgicas futuras tras la administración de sustancias que contengan estructuras proteicas y/o químicas similares. No se recomienda el tamizaje de personas sin historia previa de reacciones alérgicas a fármacos.
Debemos evaluar cuando hay una historia previa de DHRs y se requiere el medicamento sin existir una alternativa igual de efectiva, estructuralmente distinta, y si la relación beneficio/riesgo es favorable o cuando hay historia previa de DHRs severa para otros fármacos (la mejor manera de proteger al paciente es identificar los fármacos implicados).
Existen factores tanto genéticos como ambientales que pueden predisponer a una DHRs mediada por LT. Las infecciones víricas pueden simular DHRs, pero también pueden producir interacciones con medicamentos, produciendo reacciones leves (por ejemplo, “erupción por ampicilina” secundaria a VEB) y reacciones graves (por ejemplo, asociación del Virus Herpes Humano tipo 6 y el DRESS). También la infección por VIH aumenta la frecuencia de DHRs.
La presentación de las reacciones alergicas a medicamentos no esta relacionada con antecedentes familiares positivos. Es decir, no parece estar ligada a la herencia.
El TTL permite detectar LT de memoria especificos circulantes en sangre periferica, los cuales se activan y proliferan en contacto con el fármaco en aquellos pacientes que fueron previamente sensibilizados in vivo. Ciertos LT especificos para determinadas drogas necesitan estar presentes en concentraciones suficientes en la circulación para poder detectarse una respuesta posterior a la estimulacion in vitro. El TTL tiene la ventaja de que permite evaluar LT involucrados en diferentes tipos de reacciones, no solo en la clásica reacción de hipersensibilidad. La activación de los LT mediante fármacos o mitógenos resulta en un número de cambios bioquímicos y morfológicos que culminan en la diferenciación y proliferación de los LT, y en la expansión de las células de memoria. El antígeno CD69 constituye uno de los primeros marcadores expresados en LT activados por una gran variedad de agentes mitogénicos o estimulantes. El perfil de expresión de este antígeno de activación alcanza un pico máximo a las 8 horas desde que se enfrentan los linfocitos con el fármaco a ensayar. La cinética rápida y la expresión transiente del CD69 sobre los LT proveen una medida directa de la respuesta a estímulos experimentales, reduciendo el potencial de artefactos debido a la activación in vitro. La expresión de CD69 posterior a la estimulación in vitro correlaciona con la proliferación celular, por lo tanto se considera la detección de CD69 como una herramienta útil para el diagnóstico de DHRs. Más aun, ha sido demostrado que la frecuencia de células CD69+ posterior a la estimulación con el fármaco en estudio es mayor que la proliferación de LT específicos. Esto se debería a la activación de LT no específicos a través de la secreción de IL-2 por los LT específicos, dando lugar a un aumento en la expresión de CD69. Dado que este fenómeno solo se observa si los LT específicos están presentes, la especificidad de la prueba no se ve afectada y se obtiene una mejora en la sensibilidad de la misma.
Actualmente es de utilidad en los estudios de DHRs, medir la activación de los linfocitos y la expresión de marcadores en su superficie como CD69 frente a fármacos mediante el llamado Test de Transformación Linfoblástica. El mismo consiste en incubar la sangre entera con el fármaco o sustancia potencialmente activadora in vivo y determinar posteriormente mediante citometría de flujo el porcentaje de linfocitos CD69+ luego de la estimulación, comparando con células control no estimuladas, valorando si se produce una respuesta inmunológica que explique o confirme la reacción alérgica que presenta el paciente.
Es un método seguro comparado a la pruebas in vivo y tiene la ventaja de que se pueden evaluar diferentes drogas en el mismo momento.

La sensibilidad y la especificidad del TTL son dependientes de los fármacos evaluados y de las distintas entidades clínicas involucradas, en general se estima una sensibilidad del 60-70 % con una especificidad del 85 % para esta prueba.
Altos valores de activación no se asocian con la severidad de los síntomas clínicos, son solo el reflejo de una alta frecuencia de precursores de LT específicos del fármaco en estudio.
El TTL ha demostrado ser una herramienta útil en pacientes con exantema generalizado de diversos tipos (maculopapular, bulloso, pustular), en pacientes con DRESS y con reacciones anafilácticas severas “like” IgE mediadas. Las reacciones de hipersensibilidad generalizadas que involucran la piel y el hígado (como ocurre en DRESS) frecuentemente son positivas para TTL. Además ha sido reportado positividad en pacientes con pancreatitis autoinmune, enfermedad intersticial de pulmón, fiebre y vasculitis. En hepatitis medicamentosa, el TTL puede ser positivo y un instrumento útil para discriminar entre hepatitis inmune de reacciones tóxicas por drogas antituberculosas. Este test, es más bien, rara vez positivo en discrasias sanguíneas como anemia hemolítica o aplasia; en TEN, donde un TTL positivo es una excepción y en vasculitis de pequeños vasos (ANCA-negativas).
Idealmente, el estudio de alergia a medicamentos debería llevarse a cabo 4-8 semanas después de la resolución completa de todos los síntomas clínicos en la mayoría de las DHRs. La realización del mismo durante la reacción aguda podría dar lugar a resultados falsos negativos ya que los LT son fuertemente activados. Sin embargo se han reportado que reacciones de TTL pueden ser observadas cuando los test son realizados en estadios agudos (para MP, erupción maculo papular, SJS y TEN) excepto para DIHS/DRESS (Síndrome de Hipersensibilidad/Rash por drogas y eosinofilia con síntomas sistémicos), en los cuales las reacciones positivas de TTL pueden ser exclusivamente observadas luego de 1-2 meses de producido el debut de la enfermedad (erupción cutánea). Esta diferencia observada, parece estar dada porque en el estadio agudo de DIHS/DRESS pero no en otro tipo de reacciones a drogas, hay un aumento importante en la frecuencia de LT regulatorios que una vez recuperado el paciente retornan a sus valores normales. Así una probable expansión de LT regulatorios podría contribuir negativamente a la reacción de TTL en el estadio agudo.
El TTL evalúa la respuesta de LT de memoria, por lo tanto puede permanecer positivo por muchos años. Ha sido reportada positividad luego de 10-20 años posterior al tratamiento con b-lactámicos o carbamazepina, los cuales originalmente habían causado DHRs. Sin embargo, en otros pacientes se observó perdida de reactividad en un tiempo de 3-4 años. Hasta el momento, no es posible predecir si la reactividad en un paciente en particular puede persistir o no, y si en aquellos que pierden la reactividad podrían tolerar una nueva exposición a la droga por lo tanto se recomienda realizar el TTL antes de los 3-4 años de presentada la DHRs.
La respuesta de los LT de memoria parece ser aún más intensa para las DHRs no inmediatas que para las inmediatas. Por lo tanto, se recomienda evitar de por vida el fármaco implicado y aquellos con posible reactividad cruzada cuando exista reacción alérgica a fármacos.
Existen interferencias por el tratamiento con drogas que pueden dar lugar a falsos negativos como ocurre con los corticoides, ya que frecuentemente causan linfopenia y además inhiben la secreción de citoquinas por los LT. Otras drogas inmunosupresoras como metotrexato, ciclofosfamida y azatioprima interfieren en menor medida con la activación y proliferación de los LT y se puede realizar el test si no hay linfopenia. Tambien puede haber falsos negativos por ingesta de Anticonceptivos orales.
La positividad del TTL frente a un alérgeno concreto indica la presencia de una sensibilización a dicho alérgeno. Es decir, una propensión, no la obligación, a desarrollar una reacción alérgica. Por otro lado, es importante tener en cuenta que la negatividad de esta prueba frente a un fármaco no excluye la sensibilización a dicho fármaco.
Es necesario complementar los análisis in vitro con las pruebas in vivo, y siempre relacionarlas con los síntomas que presenta el paciente; por lo que el papel médico del Alergista es fundamental para la indicación y evaluación correcta de todas las pruebas.
Autora: Dra. Romina Ranocchia. Área Inmunología - Autoinmunidad Fares Taie Instituto de Análisis.
Contacto: citometria@farestaie.com.ar
Bibliografía
- Consenso Internacional sobre Alergia a Fármacos (ICON). Demoly et al. Allergy 2014; 69: 420-437.
- Utility of the lymphocyte transformation test in the diagnosis of drug sensitivity: dependence on its timing and the type of drug eruption. Kano et al. Allergy 2007: 62: 1439–1444. 2007
- The lymphocyte transformation test in the diagnosis of drug hipersensitivity. Picher et al. Allergy 2004: 59: 809-820
- Immunological evaluation of drug allergy. Blanca et al. Allergy Asthma Immunol Res.2012 (5):251-263.
- Rapid flow cytometric method for measuring lymphocyte subset activation. Ruitenberg et al. Cytometry 20:127-133 (1995).
- In Vitro Methods for Diagnosing Nonimmediate Hypersensitivity Reactions to Drugs. Torres et al. J Investig Allergol Clin Immunol 2013; Vol. 23(4): 213-225.
- T-cell-mediated drug hypersensitivity: immune mechanisms and their clinical relevance. Pichler et al. Asia Pac Allergy 2016; 6:77-89
Prestaciones ofrecidas en Fares Taie Instituto de Análisis:
| Código | Determinación | Método | Tipo de Muestra | Días de Procesos | Tiempo entrega (días hábiles) |
| 3113, 2623, 2624, 2625, 2626 | Test de Transformación Linfoblástica (TTL) | Citometría de Flujo | 5 ml de sangre entera con heparina | Martes y jueves | 7 |
Acceda desde aquí a los listados de drogas disponibles para las diferentes determinaciones:

